|
|
|
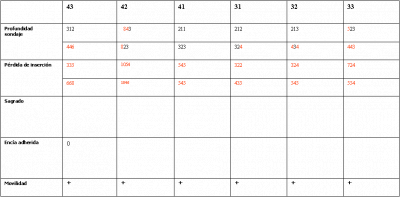
Vives T, Calvo J, Santos A. Derivado de proteínas del esmalte para el tratamiento de defectos infraóseos. Oper Dent Endod 2005;5:34 Derivado de proteínas del esmalte (Emdogain ©) para el tratamiento de defectos infraóseos. A propósito de un caso.Teresa Vives* Javier Calvo* Antonio Santos** *Master Periodoncia **Jefe de Área de Periodoncia Universitat Internacional de Catalunya Barcelona ,España INTRODUCCIONIntroducciónDesde hace ya casi tres décadas la periodoncia incorporó dentro de su vasto armamentarium de técnicas quirúrgicas la regeneración periodontal. Así en el transcurso de los años han ido apareciendo diferentes técnicas y materiales para lograr restituir los tejidos que rodean al diente y así mejorar el pronóstico del área tratada y de toda la boca en general.Uno de estos nuevos materiales, introducido aproximadamente hace casi una década, se trata de las proteínas derivadas del esmalte porcino (Emdogain) El Emdogain es un derivado de proteínas del esmalte obtenido de dientes porcinos en formación. Imita la actividad de las células epiteliales de la vaina radicular de Herztwig , secretando proteínas de la matriz del esmalte y generando la formación de cemento acelular. Los depósitos de cemento son un prerrequisito para la formación del ligamento periodontal y de hueso alveolar, para el desarrollo del aparato de inserción periodontal. Esta es la base por la que se cree que Emdogain (EMD) favorece la regeneración periodontal (Hammarstrom 1997).(1) La formulación del EMD consta de una matriz: formada por proteínas del esmalte: amelogenina (90%), enamelinas, ameloblastina y por enzimas como la MMP-20 y la EMSP1. Se ha incorporado un vehículo para favorecer la precipitación de la amelogenina hidrofóbica, este vehículo es el PGA: Propilene Glicol Alginato. Desde su introducción en 1997, se han realizado un gran número de estudios en relación al modo de acción, uso y aplicaciones del EMD. A continuación se revisan los estudios mas relevantes. Estudios in vitro:Gestrelius en un estudio in vitro ,en 1997, detectó que el EMD inducía la proliferación de las células del ligamento periodontal, aumentaba las proteínas, el colágeno y también la mineralización. Sin embargo, EMD no posee efecto en la proliferación de las células epiteliales. El uso de EMD favorece el crecimiento de las células mesenquimales sobre el crecimiento de las células epitelilales y posee un efecto citostático sobre las células epiteliales.(2)Nyman en 1982, demostró que EMD inhibe la proliferación y el crecimiento de las células epiteliales, creando un efecto barrera similar a las membranas de barrera para la GTR.(3) EMD crea un ambiente favorable para la proliferación de las células del ligamento periodontal, para el metabolismo y síntesis proteica y también favorece la inserción de células del ligamento periodontal. También favorece la proliferación de cementoblastos y osteoblastos y la diferenciación y síntesis de matriz proteica. En cambio, inhibe la proliferación y el crecimiento de las células epiteliales. No se han detectado respuestas del sistema inmune, ni respuesta humoral ni celular; se puede afirmar que EMD es un material biocompatible. (Peteinaki 1998) (4) En un modelo de placa dental exvivo, se hallo un efecto inhibitorio de EMD frente a la placa bacteriana (Sculean 2001). Spahar y colaboradores en el año 2002 detectaron tras la cicatrización postquirúrgica, un efecto selectivo en la restricción del crecimiento de periodontopatógenos. EMD inhibía el crecimiento de patógenos Gram –, mientras que la composición de Gram + no se alteraba. (5) Estudios en animales:La capacidad de EMD para regenerar fibras extrínsecas acelulares de cemento fue demostrado por primera vez en monos por Hammarstrom en 1997.(6,7)El primer estudio de este autor, consistió en la exodoncia atraumática de cuatro incisivos laterales. Inmediatamente, se realizó una cavidad en cada raíz. Estas cavidades fueron tratadas con EMD y los dientes fueron reimplantados. Tras 8 semanas de cicatrización, se demostró histológicamente la formación de cemento acelular insertado en la dentina. En los incisivos sin tratamiento con EMD se formó una capa gruesa de tejido duro celular pobremente insertado a la dentina denudada.(7) En otro estudio de Hammarstrom y colaboradores en 1997, se crearon quirúrgicamente dehiscencias óseas de 6mm en las tablas vestibulares maxilares de monos. Tras aplicar EMD y pasadas 8 semanas se demuestra histológicamente la regeneración de todos los tejidos periodontales: cemento acelular, ligamento periodontal y hueso alveolar. Los autores atribuyen las propiedades de regeneración periodontal a las amelogeninas del EMD. Las características de EMD en relación a su habilidad para formar hueso fueron estudiadas en el año 2000 por Boyan y colaboradores en ratones. Se les implantó EMD en el músculo, no se encontró formación de hueso. Si se aplicaba DFDBA con EMD solo se favorecía la formación ósea si la concentración de EMD era superior a 4mg. El EMD es un agente osteoconductor, ya que potencia el potencial osteoinductivo del material injertado pero se requiere una dosis mínima de 4mg.(6) Varios estudios en animales han comparado los resultados clínicos e histológicos tras la utilización de GTR versus el uso de EMD. Sculean y colaboradores en el año 2000, realizaron un estudio donde trataba defectos de fenestraciones en monos con EMD, con GTR o con colgajo de reposición coronal. Tras 5 meses, la capacidad de regeneración periodontal de la GTR parecía mas predecible que el EMD.(8) El mismo grupo de autores, usando un modelo animal similar, realizaron otro estudio donde trataban defectos infraóseos con EMD, con GTR ,con una combinación de GTR y EMD o con un colgajo de reposición coronal de control. Tras 5 meses, el lado control cicatrizó mediante epitelio largo de unión, el grupo de GTR demostró regeneración periodontal si las membranas no se exponían, el grupo de EMD mostró regeneración a varios niveles y la combinación de EMD + GTR no demostró mejora en los resultados. Araujo y Lindhe en 1998 confirman estos resultados, pero observaron que con la combinación EMD + GTR se formó un cemento acelular, mientras que mediante la GTR el cemento obtenido es celular.(9) Los resultados de estos estudios preclínicos en animales demuestran que EMD presenta capacidad para regenerar: ligamento periodontal, cemento acelular y hueso (menos demostración). Como EMD potencia la capacidad osteoinductiva de los materiales de injerto, se recomienda el uso de EMD combinado con material osteoinductivo si se requiere la formación ósea. La regeneración periodontal es menos predecible con el uso de EMD versus la GTR. El uso de EMD combinado con GTR parece no poseer valor añadido.(6,7,8,9) Estudios en humanos:A) Estudios clínicos en humanos:En 1997 Zattersrtöm probó la biocompatibilidad del EMD. Tras 107 cirugías periodontales utilizando EMD no se obtuvo aumento en los anticuerpos en ningún paciente. (10)Uno de los primeros estudios clínicos fue realizado por Heijl y colaboradores en 1997. Se trataba de un estudio randomizado multicéntrico para comparar el efecto a largo plazo del tratamiento con un colgajo de Widman Modificado y placebo o el mismo colgajo con EMD. Tras 36 meses, el grupo tratado con EMD obtuvo mejores resultados clínicos: ganancia del nivel de inserción clínico, reducción de la profundidad de bolsa y restauración de hueso radiográficamente (11). Estos resultados fueron confirmados por posteriores estudios de Zetterström et al 1997, Pontoriero et al 1999 , Okuda et al 2000, Silvestri et al 2000, Sculean et al 2001, Tonetti et al 2002, Zucchelli et al 2002. También aparecen estudios que muestran mejoras clínicas y radiográficas mediante el uso de EMD en el tratamiento de defectos infraóseos (Hedenet al 1999, 2000, Sculean et al 1999, Heard et al 200 y Parashis y Tsiklakis en 2000). En 2001, Froum y colaboradores demostraron la superioridad del EMD versus un colgajo de desbridamiento, para el tratamiento de defectos infraóseos. Tras 12 meses de la intervención quirúrgica se realizó la reentrada. La media del relleno óseo tras el uso de EMD fue 2.4mm superior versus el colgajo de desbridamiento.(12) Sin embrago, la aplicación subgingival del EMD tras el tratamiento no quirúrgico de defectos infraóseos, no demostró regeneración histológicamente. (Sculean et al 2003, Gutierrez et al 2003). (13) B) Estudios histológicos en humanos:En 1997, Heijl y colaboradores realizaron la primera histología en humanos. En un incisivo inferior, que precisaba exodoncia por motivos ortodónticos, se creó una dehiscencia similar a la usada en los estudios con monos. Tras 4 meses la histología demostró la formación de: nuevo ligamento periodontal, cemento acelular y hueso alveolar (11,14). Confirmado por estudios de Melloning en 1999, Sculean et al 2000, Windisch et al en 2002. Sin embargo, existen algunos estudios contradictorios. Parodi en 2000, realizó un estudio de 21 casos tratados con EMD. Aunque se observaron mejoras clínicas, de las 2 histologías realizadas, no se evidenció regeneración periodontal (15). En otro estudio, Yukna y Mellonig 2000 realizaron la histología de 10 defectos tratados con EMD. De estos: 3 demostraron regeneración (cemento, hueso y ligamento periodontal nuevos), 3 revelaron nueva inserción (sólo adhesión/ inserción de tejido conectivo) y 4 cicatrizaron con un epitelio largo de unión (16). En el año 2005, Esposito y colaboradores en un estudio concluyen que el uso de EMD no resultó con mejoría de inserción clínica ni radiográfica (17). Esposito y colaboradores realizaron un meta-análisis de estudios de EMD. No se hallaron estudios randomizados de 5 años de seguimiento. Así, tras un período de 1 año de seguimiento, la aplicación de EMD mejoraba significativamente los niveles de inserción al sondaje (1.2mm) y la profundidad de sondaje disminuía (0.8mm), cuando se comparaba con un placebo o control, aunque se halló una gran heterogeneidad en los resultados. No se hallaron diferencias en cuanto a la pérdida dentaria ni en los resultados estéticos según el criterio de los pacientes (17). En resumen, el EMD para el tratamiento de defectos infraóseos resulta en la mejora de los parámetros clínicos en términos de profundidad de sondaje, reducción y ganancia de inserción, comparado con colgajos de acceso o de Widman modificado. Aunque la cicatrización ocasionalmente es regeneración periodontal verdadera, esto no puede considerarse como un resultado predecible y reproducible (18,19,20). EMD versus GTR:Estudios histológicos avalan el uso de GTR para la regeneración periodontal. Aunque el éxito de estas técnicas está sujeto a factores de la técnica, morfología de los defectos y a la contaminación de las membranas expuestas. En el año 1999, Pontoriero y Silvestri no encontraron diferencias estadísticamente significativas entre EMD y GTR en cuanto a la disminución de la profundidad de sondaje y de los niveles de inserción clínica (21). En 1999, Silvestri y colaboradores encontraron diferencias según el nivel de inserción inicial pero estas diferencias no fueron clínicamente significativas. Si el nivel de inserción inicial era > 9mm , la GTR presentaba mejores resultados (21). En el 2002, Zucchelli et al, realizaron un estudio comparando el uso de GTR con membranas de e-PTFE+Ti versus EMD. Mediante las membranas de e-PTFE+Ti, se consiguió mayor ganancia de inserción, mayor reducción de la profundidad de sondaje pero se obtuvo mayor recesión En el año 2003, Zucchelli y colaboradores demostraron que ante una pérdida de inserción inicial >8mm, se conseguía una ganancia de inserción de 0,3mm mayor con GTR que con EMD, esta diferencia no es clínicamente relevante (22). Histológicamente, con el uso de la GTR es mas predecible la formación de cemento y hueso que utilizando EMD. En ambos procedimientos, es imprescindible un control estricto de la placa bacteriana por parte del paciente así como mantenimientos periodontales estrictos. En 2005, Esposito y colaboradores en su metaanálisis concluyen que de los 5 estudios hallados que comparen el uso de EMD versus GTR, la GTR resultó con un aumento significativo de las recesiones (0,4mm) y con mayores complicaciones postoperatorias. No se hallaron otras diferencias clínicas entre los tratamientos con EMD y con GTR (17). No se hallaron estudios comparando el EMD con injertos óseos (21). Caso Clínico:Un paciente varón, de raza caucásica de 65 años de edad acude al Departamento de Periodoncia de la Universidad Internacional de Catalunya para tratar su patología periodontal. El paciente no refiere ninguna patología sistémica asociada. Se realiza chequeos y analíticas anuales con resultados dentro de la normalidad. Como antecedente médicos de interés refiere una intervención quirúrgica de hernia discal hace 7 años.No toma medicación actualmente, ni refiere alergias a medicamentos conocidas. Presenta antecedente familiares de periodontitis (padre). Es exfumador de 40 cigarros /día, desde hace 17 años. El paciente no acudía de forma regular a la consulta dental y su régimen de higiene oral a la primera visita era: cepillado con cepillo medio 1 vez/ día y esporádicamente usaba los cepillos interproximales. Inicialmente se realizó una fase higiénica, esta consistió en raspado y alisado radicular por cuadrantes y bajo anestesia con enjuagues de clorhexidina al 0,12%. Pasado un mes y medio se realizó una reevaluación del caso. El periodontograma inicial y el de reevaluación se indican a continuación (Fig. 1.1 y 1.2 ) Tras anestesiar la zona, se realizó el sondaje a hueso (Fig.2), que junto a las radiografías periapicales (Fig.3) nos hizo sospechar en la presencia de unos defectos infraóseos entre 33-32 y 43-42. 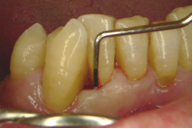 Fig. 2 Sondaje a hueso 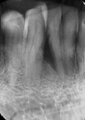 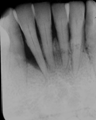 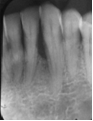 Fig. 3Radiografías periapicales La fig. 4 nos muestra el aspecto de la zona preoperatorio. 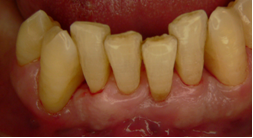 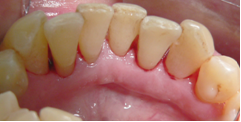 Fig. 4Fotos iniciales. Vestibular y lingual Tras anestesiar mediante anestesia infiltrativa, se realizó un diseño del colgajo con propósitos regenerativos. Las incisiones vestibulares y linguales fueron intrasulculares, de línea ángulo mesial del 43 a línea ángulo mesial del 33, intentando preservar el máximo de tejido gingival (Fig 5). 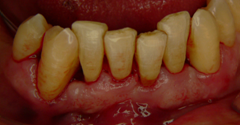 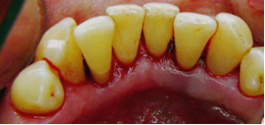 Fig. 5. Incisiones intrasulculares. Vestibular y lingual Se levantaron los colgajos vestibular y lingual a espesor total. Se procedió a la remoción de todo el tejido de granulación, depósitos radiculares y restos de tejido para exponer el hueso.(Fig6) Se controló la hemorragia del defecto con gasas estériles. Se observan defectos infraóseos: entre 43-44 un defecto combinado de tres paredes en apical y de 2 paredes, de 6mm de altura y entre 33 y 43 un defecto de 2 paredes y de 4mm de altura (Fig.6) 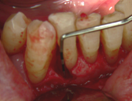 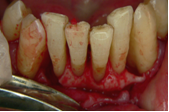 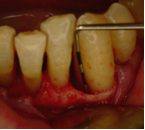 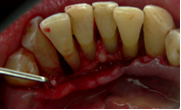 Fig. 6. Defectos infraóseos A continuación se realizó la desmineralización de la raíz con el fin de eliminar la capa de residuos y facilitar la adhesión del EMD. Se puede utilizar el ácido cítrico o fosfórico (pH 1) durante 15 segundos o el EDTA al 24% (ácido etilenodiaminotetraacético) durante 2 minutos. Tras aplicar el EDTA se irrigó con suero fisiológico estéril. Se procede a aplicar el EMD, empezando desde el nivel superior del hueso apical y cubriendo las raíces expuestas derramando gel de EMD. (Fig. 7) 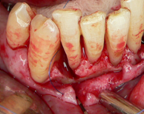 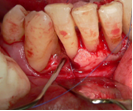 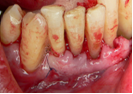 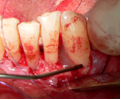 Fig. 7. Fotos iniciales. Vestibular y lingual Mediante suturas en ocho se consigue el completo cierre primario de la lesión. (fig. 8) 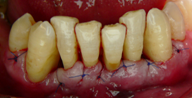 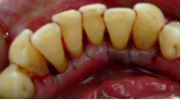 Fig. 8. Sutura Se prescribió Ibuprofeno 600 mg 1 c/8horas durante 7 días y enjuagues con clorhexidina al 0,12% durante 15 días. A parte de las recomendaciones postquirúrgicas habituales se recomendó no cepillarse la zona operada durante 15 días. A la semana de la intervención se citó al paciente para un control de la herida y tras 15 días, se procedió a la retirada de las suturas.(Fig. 9) 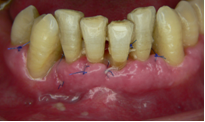 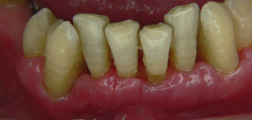 Fig. 9. Retirada de sutura a los 15 días Finalmente se hicieron controles al mes (fig. 10), 3 meses y 5 meses (fig. 11) 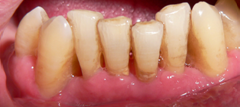 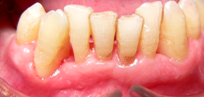 Fig. 10. Control a 1 mes 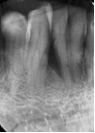 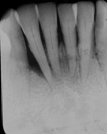 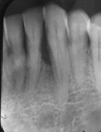 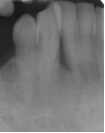 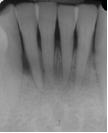 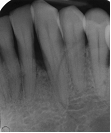 Fig. 11 Comparativa entre radiografías al inicio y a los 5 meses BIBLIOGRAFÍA(1) Hammarström L, Heijl L, Gestrelius S. Periodontal regeneration in a buccal dehiscence model in monkeys after application of enamel matrix proteins. J Clin Periodontol 1997;24:669-677 (2) Gestrelius S, Andersson C, Lidström D. In vitro studies on periodontal ligament cells and enamel matrix derivate. J Clin Periodontol 24:685-692 (3) Nyman S, Lindhe J, Karring T, Rylander H. New attacment following surgical treatment of human periodontal disease, J Clin Periodontol 9:290-296 (4) Peteinaki E, Nikolopoulusus S, Castanas E. Low estimulation of peripheral lymphocytes following in vitro application of Emdogain. J Clin Periodontol 1998;25:715-720 (5) Sculean A, Auschill TM, Donos N, Brecx M, Reich E. Effect of enamel matrix derivative (Emdogain) on ex vivo dental plaque vitality. J Clin Periodontol 2001 28:397-403 (6) Hammarström L, Heijl L, Gestrelius S. Periodontal regeneration in a buccal dehiscence model in monkeys after application of enamel matrix proteins. J Clin Periodontol 1997;24:669-677 (7) Hammarström L. Enamel matrix, cementum development and regeneration. J Clin Periodontol 1997;24:658-668 (8) Sculean A, Donos N, Brecx M, Karring T, Reich E. Healing of fenestration-type defects following treatment with guided tissue regeneration or enamel matrix proteins. An experimental study in monkeys. Ciln Oral Investig 2000;4:50-56 (9) Sculean A, Donos N, Brecx M, Karring T, Reich E. Treatment of intrabony defects with guided tissue regeneration and enamel-matrix-proteins. An experimental study in monkeys. J Clin Periodontol 2000; 27:466-472 (10) Zattersrtöm (11) Heijl L. Periodontal regeneration with enamel matrix derivative in one human experimental defect. J Clin Periodontol 1997;24:693-696 (12) Froum SJ, Weinberg MA, Rosenberg E, Tarnow D. A comparative estudy utilizing open flap debidement with and without enamel matrix derivative in the treatment of periodontal intrabony defects: a 12-months re-entry study. J Periodontol 2001;72:25-34 (13) Gutierrez MA, Melloning J, Cochran DL. Evaluation of enamel matrix derivate as an adjunct to non-surgical periodontal theraphy. J Clin Periodontol 2001;30:739-745 (14) Heijl L, Heden G, Svardström G, Ostgren A. Enamel matrix derivative (Emdogain) in the tratment of infrabony periodontal defects. J Clin Periodontol 1997;24:705-714 (15) Parodi R, Liuzzo G, Patrucco P, Brunel G, Santarelli GA, Biradi V. Use of Emdogain in the treatment of deep intrabony defects:12-months clinical results. Histologic and radiographic evaluation. Int J Periodontol Rest Dent 2000;20:585-595. (16) Yukna RA, Melloning JT. Histologic evaluation of periodontal healing in humans following regenerative theraphy with enamel matrix derivate. A 10-case series. J Periodontol 2000;71:752-759 (17) Esposito M, Grusovin MG, Coulthard P, Worthingthon HV. Enamel derivative (Emdogain) for periodontal tissue regeneration in intrabony defects. Review. The Cochrane Database Systematic Reviews 2005. (18) Cardaropoli G, Leonhardt AS. Enamel matrix proteins in the treatment of deep intrabony defects. J Periodontol 2002;73:501-504 (19) Garrett S. Periodontal regeneration around natural teeth. Ann Periodontol 1996;1:621-666. (20) Kaldipis CDR, Ruben MP. Treatment of intrabony periodontal defects with enamel matrix derivative: a literature review. J Periodontol 73:1360-1376 (21) Pontoriero R, Silvestri A, Lindhe. The use of barrier membrane and enamle matriz proteins in the treatment of angular bone defects. A prospective controlled ilical study. . J Clin Periodontol 1999;26:833-840 (22) Zucchelli G, Bernardi F, Montebugnoli L, De Sanctis M. Enamel matrix proteins and guded tissue regenertation with titanium-reinforced expanded politetrafluoroethilene membranes in the treatment of intrabony defects: a comparative contolled clinical trial. J Periodontol 73:3-12 |
| < Anterior | Siguiente > |
|---|