| PERIODONCIA: Preservación alveolar con membrana no reabsorbible d-PTFE y xenoinjerto. |
|
|
Escudé, Mariona; Calvo, Xavier; Carrió, Neus; Paniagua, Blanca; Nart, José. Preservación alveolar con membrana no reabsorbible d-PTFE y xenoinjerto. A propósito de un caso. Volumen 2, núm. 1-1. Epub Febrero 2013.La preservación alveolar se realiza en alvéolos post-extracción para minimizar la reabsorción ósea que se produce durante la cicatrización, tanto a nivel horizontal como vertical.
Muchos estudios han descrito el uso de membranas reabsorbibles de colágeno o las no reabsorbibles de e-PTFE en este tipo de procedimientos. Estas membranas necesitan de un cierre por primera intención y pueden infectarse si se exponen en la cavidad oral.
Este artículo explora el uso de las membranas no reabsorbibles de politetrafluoroetileno de alta densidad (d-PTFE) que no requieren de un cierre por primera intención de los tejidos blandos. Se discuten las ventajas, su significancia clínica y se presenta un caso clínico de un paciente en el cual se le realiza una preservación alveolar del diente 3.6 con una membrana no reabsorbible d-PTFE y xenoinjerto para una posterior rehabilitación con implante.
Preservación alveolar con membrana no reabsorbible d-PTFE y xenoinjerto. A propósito de un caso.Mariona Escudé * Xavier Calvo * * Neus Carrió * * Blanca Paniagua * * José Nart * * * *Alumno Máster de Periodoncia * *Profesor Máster de Periodoncia ***Director Máster de Periodoncia Universidad Internacional de Catalunya ResumenLa preservación alveolar se realiza en alvéolos post-extracción para minimizar la reabsorción ósea que se produce durante la cicatrización, tanto a nivel horizontal como vertical.
Muchos estudios han descrito el uso de membranas reabsorbibles de colágeno o las no reabsorbibles de e-PTFE en este tipo de procedimientos. Estas membranas necesitan de un cierre por primera intención y pueden infectarse si se exponen en la cavidad oral.
Este artículo explora el uso de las membranas no reabsorbibles de politetrafluoroetileno de alta densidad (d-PTFE) que no requieren de un cierre por primera intención de los tejidos blandos. Se discuten las ventajas, su significancia clínica y se presenta un caso clínico de un paciente en el cual se le realiza una preservación alveolar del diente 3.6 con una membrana no reabsorbible d-PTFE y xenoinjerto para una posterior rehabilitación con implante. INTRODUCCIÓNActualmente, los implantes dentales representan una terapia alternativa predecible para el tratamiento de pacientes parcial o completamente desdentados. Para conseguir un tratamiento exitoso con implantes es imprescindible la osteointegración del implante al hueso y, para ello, es necesario disponer de un volumen óseo adecuado. Una cresta reabsorbida nos dificultará la colocación del implante en posición óptima. Por este motivo, en aquellas situaciones clínicas en las que existe una deficiencia ósea, sería necesario realizar técnicas de regeneración ósea guiada (ROG) para la futura colocación del implante.
Una de las causas más frecuentes de disminución de reborde es por la pérdida de dientes o la extracción dental, causados por enfermedad avanzada, fracaso endodóntico, fracturas y traumatismos. El procedimiento quirúrgico conocido como preservación del reborde alveolar pretende minimizar los cambios dimensionales que se producen durante la cicatrización, tanto a nivel vertical como horizontal. (1) Estudios clínicos y radiológicos han observado que la mayor parte de los cambios dimensionales se producen durante los primeros 3 meses de cicatrización, aunque éstos pueden continuar hasta los 12 meses postextracción. (2,3,4) Asimismo, han observado que ésta reabsorción es más pronunciada en la pared vestibular y a nivel horizontal, pudiendo llegar a reducir el reborde alveolar hasta un 50%. (2,3) Para entender éstos cambios es imprescindible comprender el proceso de reabsorción de las paredes del alveolo, el cual ha sido dividido en dos fases o etapas. En una primera fase, el hueso fasciculado es reabsorbido y reemplazado por hueso reticular y, en una segunda fase, el hueso reticular es reemplazado, paulatinamente, por hueso laminar y médula ósea. La presencia de hueso fasciculado depende del ligamento periodontal del diente, por lo tanto, la exodoncia de un diente conlleva intrínsecamente una serie de cambios en el alveolo. Además, la presencia de éste hueso es mayor en vestibular que en lingual o palatino. De hecho, los primeros 1-2 mm de la tabla vestibular son de hueso fasciculado, a diferencia de la tabla lingual o palatina, donde sólo una pequeña parte de la cresta contiene dicho hueso. Asimismo, la tabla vestibular es más estrecha, por lo tanto, tendremos mayor pérdida ósea vertical. (1,2,4)
En los últimos años se han utilizado diferentes técnicas y materiales para el procedimiento quirúrgico de preservación del reborde alveolar. (1,5,6) En la actualidad, existe un gran número de materiales sustitutivos óseos que pueden clasificarse conforme a diferentes criterios, de acuerdo con su procedencia y propiedades. Según su procedencia los clasificamos en: autoinjertos, aloinjertos, xenoinjertos y materiales aloplásticos.
- autoinjertos: injertos óseos que provienen de una zona donante del mismo individuo. Son osteogénicos, pero presentan una alta reabsorción.
- aloinjertos: injertos óseos de un miembro de la misma especie. Éstos pueden ser mineralizados (FDBA: freeze-dried bone allograft) o desmineralizados (DFDBA: demineralized freeze-dried bone allograft). En principio, se les atribuyen propiedades osteoinductivas y osteoconductivas.
- xenoinjertos: injertos óseos de otras especies (bovino, porcino,…) con propiedades osteoconductivas.
- materiales aloplásticos: injertos óseos de origen sintético (hidroxiapatita, vidrio bioactivo, fosfato tricálcico,…). Tienen propiedades osteoconductivas, aunque las partículas de injerto suelen encapsularse con tejido blando. Estos materiales de injerto se basan en tres mecanismos biológicos que promueven la curación del alvéolo:
- osteogénesis: formación de nuevo hueso a partir de osteoblastos viables y precursores, trasplantados con el material de injerto.
- osteoinducción: formación de nuevo hueso por diferenciación de células del tejido conectivo local en células formadoras de hueso, bajo la influencia de uno o más agentes inductores (proteínas morfogenéticas,…). - osteoconducción: formación de nuevo hueso por el entramado generado por un material de injerto no vital, el cual permite la penetración de osteoblastos precursores presentes en el defecto.
El injerto óseo, por sí mismo, puede llegar a promover el crecimiento óseo. No obstante, debido a la naturaleza del alvéolo postextracción, la mayor parte del injerto puede perderse si no se aporta una protección. Por este motivo, se recomienda el uso de membranas que facilitaran la retención del material de injerto óseo y del coágulo sanguíneo en el interior del alvéolo y, al mismo tiempo, permitirán el aislamiento del tejido blando para favorecer una correcta osteogénesis (7)
Numerosos estudios han demostrado que la ROG con membranas reabsorbibles y no reabsorbibles es un procedimiento terapéutico fiable para lograr una regeneración con excelentes resultados. (8) Se han utilizado distintos materiales de barrera tales como membranas no reabsorbibles de politetrafluoroetileno (PTFE) denso (d-PTFE) o expandido (e-PTFE) con o sin refuerzo de titanio, membranas reabsorbibles de colágeno, polímeros glicólicos/lácticos, matriz dérmica acelular, así como esponjas de colágeno. El uso de las membranas no reabsorbibles de e-PTFE se ha estudiado mucho para su uso en Periodoncia observando unos buenos resultados. (8) Sin embargo, presentan algunos inconvenientes, tales como, dehiscencias del tejido blando y la consiguiente contaminación bacteriana, pudiendo llegar a producir una infección del área a regenerar. Asimismo, requieren de una segunda cirugía para su remoción. (9-11) Por estos motivos, la mayoría de profesionales utilizan membranas reabsorbibles –en particular, membranas de colágeno–, ya que parecen haber superado estos problemas. Sin embargo, la longevidad de las membranas reabsorbibles puede variar considerablemente, limitando su función de barrera a unas pocas semanas. Además, en el caso de las membranas de colágeno, carecen de rigidez para mantener el espacio y tienden a colapsarse. (12)
Para evitar los problemas anteriormente citados, ha sido desarrollada una membrana no reabsorbible de d-PTFE con un tamaño de porosidad submicrónico, de 0,2 μm. (9) Debido a la alta densidad y al pequeño tamaño del poro, su superficie es impenetrable para las bacterias. (10,13,14) Esto se traduce en que se pueden dejar expuestas durante el periodo de cicatrización sin que la colonización bacteriana pueda llegar a generar un proceso inflamatorio e infeccioso. (10,11) Además, como no requieren de un cierre primario, la arquitectura del tejido blando se mantiene y la manipulación de los mismos puede ser mínimamente invasiva.
Por otro lado, las características de su diseño permiten removerla mediante un procedimiento simple, no quirúrgico, similar a la remoción de sutura. (9-11)
El objetivo de este artículo es mostrar un caso clínico de preservación de cresta con un xenoinjerto y una membrana no reabsorbible de d-PTFE.
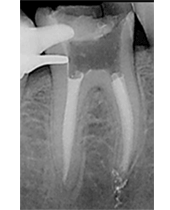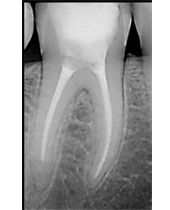
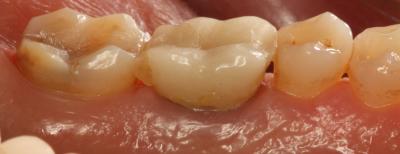
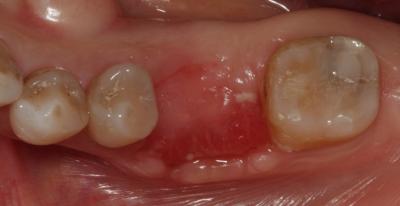
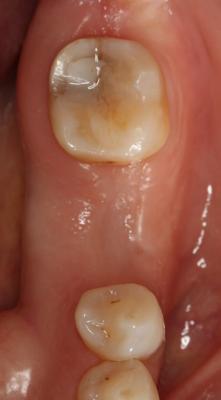
CASO CLÍNICO Se presenta un caso clínico de una paciente mujer de 39 años de edad, raza caucásica y fumadora de 3-4 cigarrillos/día desde los 25 años. La paciente acudió al Departamento de Periodoncia de la Clínica Universitaria de Odontología de la Universitat Internacional de Catalunya, derivada de Pregrado, para valorar su estado periodontal con el motivo de consulta “quiero hacerme una revisión”. La paciente no refería ninguna patología sistémica de interés ni se encontraba bajo tratamiento médico. Tras la exploración clínica y radiológica, el diagnóstico Periodontal basándonos en la clasificación de Enfermedades Periodontales de Armitage de 1999 fue de Periodontitis crónica inicial generalizada y avanzada localizada en 1.6, 2.6, 3.6 y 4.6, contacto abierto en el 2.4, perforación radicular a nivel furcal en el 3.6, coronas desajustadas en 3.6 y 4.6 y, recesiones gingivales en 1.7, 1.6, 1.4, 2.6, 3.6 y 4.6. En el examen clínico y radiográfico el 36 presentaba una recesión gingival por vestibular de 2 mm, una perforación radicular con afectación furcal tipo I por vestibular y lingual, una corona desajustada y una periodontitis apical sintomática. (Fig. 1) Fig. 1
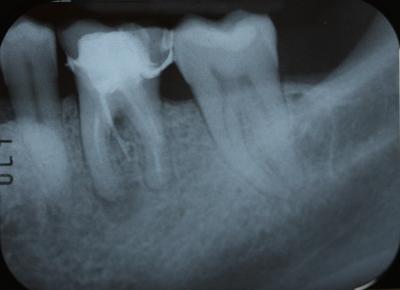
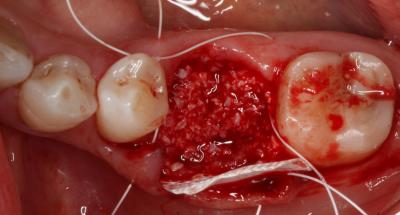
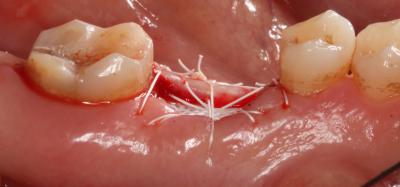
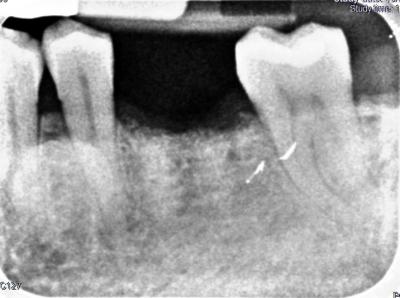
En cuanto al pronóstico periodontal, según la clasificación de McGuire del 1991, se le asignó un pronóstico pobre al 3.6 por pérdida de inserción moderada y furcas tipo I, aunque finalmente se desahució por la perforación radicular a nivel furcal. Por estos motivos, se decidió realizar la exodoncia del 3.6 y una preservación del reborde alveolar con un xenoinjerto y una membrana no reabsorbible de d-PTFE, para la posterior rehabilitación con un implante. Tras la anestesia loco-regional de la zona con articaína y epinefrina a una concentración de 1:100.000, se realizaron incisiones intrasulculares de línea ángulo mesial del 3.5 a línea ángulo distal del 3.7, por vestibular y lingual, sin adelgazar las papilas. A continuación, se elevó un colgajo a espesor total, sin sobrepasar la línea mucogingival y, se procedió a la extracción atraumática del 3.6 mediante odontosección. Seguidamente, se legró cuidadosamente el alveolo, se irrigó con suero fisiológico y se evaluó el alveolo, el cual presentaba un defecto de la cresta ósea por vestibular. (Fig. 2) Fig. 2 Posteriormente, se recortó y adaptó la membrana no reabsorbible de d-PTFE al alveolo y se realizó una pre-sutura con PTFE de 4/0. Se colocó el xenoinjerto óseo particulado de origen bovino dentro del alvéolo, previamente hidratado con suero fisiológico, y se adaptó la membrana por lingual. (Fig. 3) Fig. 3
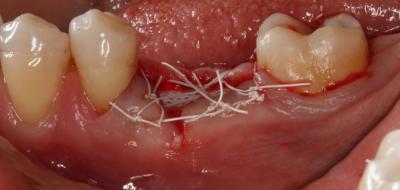
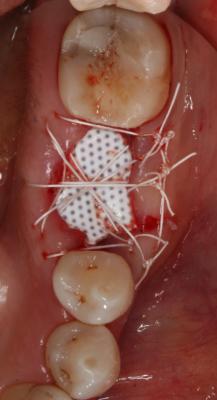
Finalmente, se realizaron tres puntos colchoneros horizontales, dos de ellos entrecruzados, y un punto simple, dejando la membrana expuesta (Fig. 4). Como instrucciones postoperatorias se le indicó a la paciente que no se cepillara la zona intervenida durante 14 días y que se enjuagara con un colutorio de clorhexidina al 0,2%, 2 veces al día, durante 1 minuto, para lograr un control químico de la placa bacteriana. También se prescribió terapia antibiótica (Espiramicina y Metronidazol 2c/8h/10 días) y antiinflamatoria (Ibuprofeno 600mg 1c/8h/7 días). Fig. 4 Fig. 5. Postoperatorio a las 3 semanas
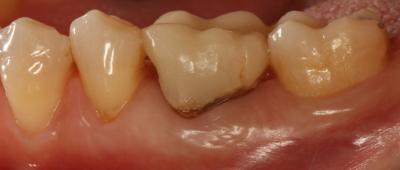
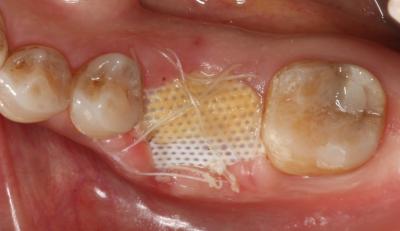
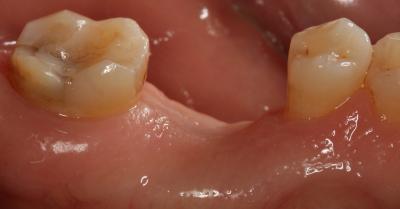
A las 6 semanas se procedió a la remoción de la membrana sin anestesia y de forma atraumática, observándose un tejido epitelizado y algunas zonas en estado de cicatrización (Fig. 6) Fig. 6
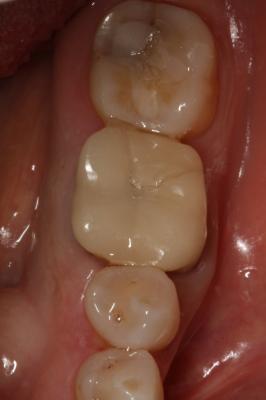
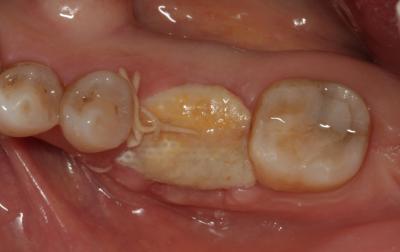
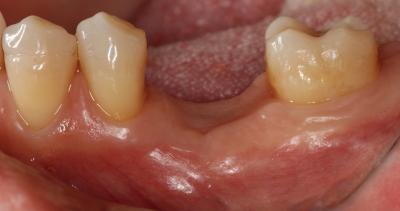
Postoperatorio a los 9 meses donde se observa el epitelio queratinizado y la minimización de la pérdida de volumen óseo a nivel horizontal y vertical. (Fig. 7) Fig. 7 DISCUSIÓNEl caso presentado en este artículo se correlaciona con previos estudios donde utilizando injertos óseos y membranas se consiguió mantener en gran medida las dimensiones de la cresta alveolar. En este caso, podemos observar a los 9 meses, tras un proceso de cicatrización satisfactorio, un mantenimiento muy considerable de la anchura y la altura del reborde alveolar. Cardaropoli (4) en su estudio demostró una pérdida media sólo de 15.68% del volumen inicial bucolingual. Otros estudios (15,16) demostraron que en los sitios donde previamente se había realizado una preservación presentaban menos reabsorción a los 6 meses comparados con las áreas sin preservación. Sin embargo, aún habiendo realizado una preservación alveolar, la reabsorción crestal en anchura fue de un 17% a un 25%. De forma muy similar, se ha reportado una pérdida de altura y anchura de cresta después de la preservación. (17) Iasella et al. (18) mostraron que había una pequeña pérdida de anchura de cresta realizando preservación con injerto y membrana pero concluyeron que aún así se mejoraban las dimensiones en altura y anchura consiguiendo unas condiciones favorables para la colocación de implantes.
Se ha descrito ampliamente en la literatura el uso de xenoinjerto de origen bovino (BioOss) en procedimientos de regeneración de alvéolos, conservando la estructura y forma de la cresta alveolar. (1,17,19)
También hay evidencia, aunque más limitada, en la utilización de membranas de d-PTFE en procedimientos de preservación.
Estudios comparativos de regeneración ósea en animales utilizando membranas e-PTFE y d-PTFE mostraron que los dos tipos de membranas dan buenos resultados, aunque en un estudio se observó mayor formación ósea cuando se utilizaba d-PTFE (20). Por el contrario, en otro estudio similar se reportó que las membranas e-PTFE provocan mayor regeneración ósea y más rápida. (21) Posteriormente, en estudios en humanos, no se observaron diferencias estadísticamente significativas. (22). La principal ventaja de la membrana d-PTFE es que se puede dejar expuesta sin necesidad de conseguir cierre por primera intención de los tejidos. La exposición de la membrana es una de las mayores complicaciones descritas en procedimientos de regeneración. Puede afectar negativamente al tratamiento, provocando contaminación bacteriana y resultando en una reducción de formación de hueso. Gher (23), utilizando membranas de e-PTFE, reportó que en un 62% de los casos, las membranas se exponían a las 2 semanas de su colocación, teniendo que ser extraidas debido a la contaminación por placa bacteriana y su consiguiente infección. Sela (24) realizó un estudio in Vitro comparando la adherencia bacteriana entre tres tipos de membrana: colágeno, e-PTFE y d-PTFE. Observó que la adhesión de las bacterias a las membranas de colágeno era significativamente más alta que las membranas de PTFE, aunque no observó diferencias estadísticamente significativas entre las membranas e-PTFE y d-PTFE. Una de las principales indicaciones de las membranas d-PTFE es aquella situación en que es prácticamente imposible conseguir un cierre por primera intención, tal como reportó Bartee en sus estudios de series de casos. (10,13) De forma muy similar y más recientemente en un estudio realizado con 420 casos de preservación con d-PTFE se demostró la capacidad que tienen estas membranas de poder dejarse expuestas y formar hueso sin peligro de infección. (11) Esta ventaja reduce la necesidad de levantar grandes colgajos y realizar incisiones verticales y liberadoras para conseguir un cierre por primera intención (7,9,11). Se ha demostrado que estas técnicas realizadas en procedimientos con membranas reabsorbibles o e-PTFE pueden provocar una reducción o eliminación de tejido queratinizado. (10,13) En cambio, con el uso de d-PTFE se puede conservar la arquitectura de tejido blando preservando el ancho de encía queratinizada, no hay pérdida de profundidad de vestíbulo y la papila interdental puede ser mantenida. (7,9,13) Otra ventaja asociada a estas membranas es la no necesidad de un segundo procedimiento quirúrgico para su remoción. La membrana d-PTFE ya está expuesta y visible en la zona quirúrgica y no se necesita anestesia local o colgajo. Extraer una membrana de d-PTFE puede ser comparable a la remoción de sutura. (7,9) Hay controversia en relación al tiempo óptimo para la remoción de la membrana. Vergara et al. (25) no reportaron ninguna diferencia significativa en los resultados de la regeneración cuando las membranas no reabsorbibles eran removidas al mes y cuando se removían más tarde. Bartee (10) aportó que el tiempo de remoción dependía del tamaño del defecto y del grado de revascularización para la formación de hueso y que mantener la membrana más allá de los 28 días podría retrasar la formación ósea. Así, una remoción temprana de la membrana (21-28 días) permitiría que el flujo de sangre de la parte superior del defecto promoviera la formación de hueso dentro del defecto. Barboza, (11) obtuvo unos resultados exitosos removiendo la membrana entre los 21 y 28 días. Barber (9), por su parte, mencionó que las membranas se debían remover entre las 4 y 6 semanas, ya que dejarlas más tiempo podría provocar una migración apical del colgajo provocando un aumento de las complicaciones sin aportar ningún beneficio en la calidad del hueso subyacente. En este caso, la membrana fue removida a las 6 semanas, mostrando unos buenos resultados. La formación de encía queratinizada con esta técnica quirúrgica se produce por epitelización por segunda intención de tejido conectivo denso contenido en el alveolo o en el área quirúrgica después de la remoción de la membrana. (9) Esta reepitelización de los tejidos aparece a los 7-10 días. (7) Histológicamente, Bartee, (14) en un estudio de regeneración ósea con d-PTFE en ratas, demostró que a las 2 semanas se empieza a formar hueso en los márgenes del defecto, a las 6 semanas ya aparece regeneración ósea en el centro del defecto, pero no es hasta las 10 semanas que hay formación de hueso completa. Más tarde, el mismo autor evaluó en humanos la regeneración ósea en defectos de alvéolo post extracción y alrededor de implantes, demostrando que a las 16 semanas post cirugía ya es evidente la maduración ósea utilizando membranas d-PTFE. Los estudios histológicos en humanos demuestran que dependiendo del injerto colocado, la mineralización del alvéolo aparece entre las 12 - 16 semanas. En defectos grandes, puede requerir hasta 6 meses de maduración. (7). Las observaciones clínicas de este caso indican que las membranas de d-PTFE expuestas intencionadamente pueden ser usadas para mantener el contorno de cresta en alvéolos postextracción con unas condiciones favorables para la colocación de implantes. Además, el uso de estas membranas también preserva el tejido queratinizado, muy importante para conseguir una buena higiene y unos tejidos periodontales sanos alrededor de implantes. Los casos clínicos demuestran unos resultados exitosos y proporcionan una evidencia clínica a considerar para futuros ensayos clínicos randomizados y controlados en los que estudiar más ampliamente los beneficios de esta técnica.
CONCLUSIONLa preservación del reborde alveolar es una técnica que ha demostrado reducir significantemente la reabsorción ósea dimensional que sufre la cresta alveolar tras la extracción de los dientes.
Las membranas de d-PTFE expuestas de forma intencional y utilizadas en procedimientos de preservación alveolar ayudan a la formación de tejido duro y blando necesario para la correcta colocación de implantes. BIBILIOGRAFIA1. Barone A, Nicoli N, Fini M, Giardino R, Calvo JL, Covani U. “Xenograft versus extraction alone for ridge preservation after tooth removal: a clinical and histomorphometric study.” J Periodontol 2008;79:1370-1377 2. Araújo MG, Lindhe J. “Dimensional ridge alterations following tooth extraction. An experimental study in the dog.” J Clin Periodontol 2005; 32:212-218 3. Schropp L, Wenzel A, Kostopoulos L, Karring T. “Bone healing and soft tissue contour changes following single-tooth extraction: a clinical and radiographic 12-month prospective study.” Int J Periodontics Restorative Dent 2003; 23:313-323. 4. Cardaropoli D, Cardaropoli G. “Preservation of the postextraction alveolar ridge: a clinical and histologic study.” Int J Periodontics Restestorative Dent 2008;28:469-477 5. Mardas N, Chadha V, Donos N. “Alveolar ridge preservation with guided bone regeneration and a synthetic bone substitute or a bovine-derived xenograft: a randomized, controlled clinical trial.” Clin. Oral Impl. Res. 21, 2010; 688–698 6. Araujo M, Linder E, Wennström J, Lindhe J. “The influence of Bio-Oss collagen on healing of an extraction socket: an experimental study in the dog.” Int J Periodontics Restorative Dent 2008;28:123-135 7. Bartee BK. “Extraction site reconstruction for alveolar ridge preservation. Part 2: membrane-assisted surgical technique.” Journal of Oral Implantology 2001; 27:194-197 8. Karring T. “Regenerative periodontal therapy.” J Int Acad Periodontol 2000 Oct;2(4):101-9 9. Barber HD, Lignelli J, Smith BM, Bartee BK. “Using a dense PTFE membrane without primary closure to achieve bone and tissue regeneration.” J Oral Maxillofac Surg 2007; 65:748-752 10. Bartee BK: “Evaluation of a new polytetrafluoroethylene-guided tissue regeneration membrane in healing extraction sites.” Compendium 19:1256, 1998 11. Barboza EP, Stutz B, Ferreira VF, Carvalho W. “Guided bone regeneration using nonexpanded polytetrafluoroethylene membranes in preparation for dental implant placements – a report of 420 cases.” Implant Dent 2010;19:2-7 12. von Arx T, Buser D. “Horizontal ridge augmentation using autogenous block grafts and the guided bone regeneration technique with collagen membranes: a clinical study with 42 patients.” Clin. Oral Impl. Res. 17, 2006; 359-366 13. Bartee BK: “The use of high-density polytetrafluoroethylene membrane to treat osseous defects: Clinical reports.” Implant Dent 4:21, 1995 14. Bartee BK, Carr JA: “Evaluation of a high-density polytetrafluoroethylene membrane as a barrier material to facilitate guided bone regeneration in the rat mandible.” J Oral Implantol 21:88, 1995 15. Lekovic V, Kenney EB, Weinlaender M, et al. “A bone regenerative approach to alveolar ridge maintenance following tooth extraction. Report of 10 cases.” J Periodontol 1997;68:563–570 16. Lekovic V, Camargo PM, Klokkevold PR, et al. “Preservation of alveolar bone in extraction sockets using bioabsorbable membranes.” J Periodontol 1998;69: 1044-1049 17. Vance G, Greenwell H, Miller R, Hill M, Johnston H, Scheetz J. “Comparison of an allograft in an experimental putty carrier and a bovine-derived xenograft used in ridge preservation: a clinical and histologic study in humans.” Int J Oral Maxillofac Impl 2004;19:491–497 18. Iasella JM, Greenwell H, Miller RL, Hill M, Drisko C, Bohra AA, Scheetz JP. “Ridge preservation with freeze-dried bone allograft and a collagen membrane compared to extraction alone for implant site development: a clinical and histologic study in humans.” J Periodontol 2003;74:990-999 19. Araújo MG, Lindhe J. “Ridge preservation with the use of Bio-Oss collagen: a 6-month study in the dog.” Clin Oral Impl Res 2009;20:433-440 20. Crump TB, Rivera-Hidalgo F, Harrison JW et al. “Influence of three membrane types on healing of bone defects.” Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1996 Oct;82(4):365-374 21. Marouf HA, El-Guindi HM. “Efficacy of high-density versus semipermeable PTFE membranes in an elderly experimental model.” Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2000 Feb;89(2):164-170 22. Lee JY, Kim YK, Yun PY, Oh JS, Kim SG. “Guided bone regeneration using two types of non-resorbable barrier membranes.” J Korean Assoc Oral Maxillofac Surg 2010;36:275-9 23. Gher ME, Quintero G, Assad D, et al. “Bone grafting and guided bone regeneration for immediate dental implants in humans.” J Periodontol. 1994;65:881-891 24. Sela MN. Steinberg D. Klinger A, Krausz AA. Kohavi D. “Adherence of periodontopathic bacteria to bioabsorbable and non-absorbable barrier membranes in vitro.” Clin Oral Impl Res 1999:10:445-52 25. Vergara JA, Quiñones CR, Nasjleti CE, et al. “Vascular response to guided tissue regeneration procedures using nonresorbable and bioabsorbable membranes in dogs.” J Periodontol. 1997; 68;217-224 |
| Siguiente > |
|---|